Profa. Elisalva Teixeira Guimarães
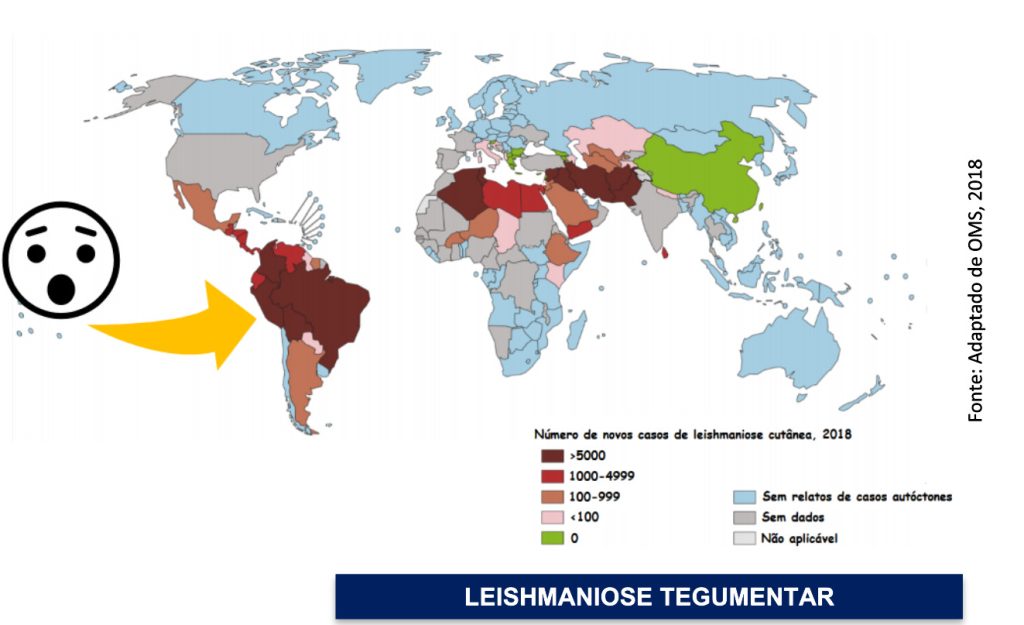
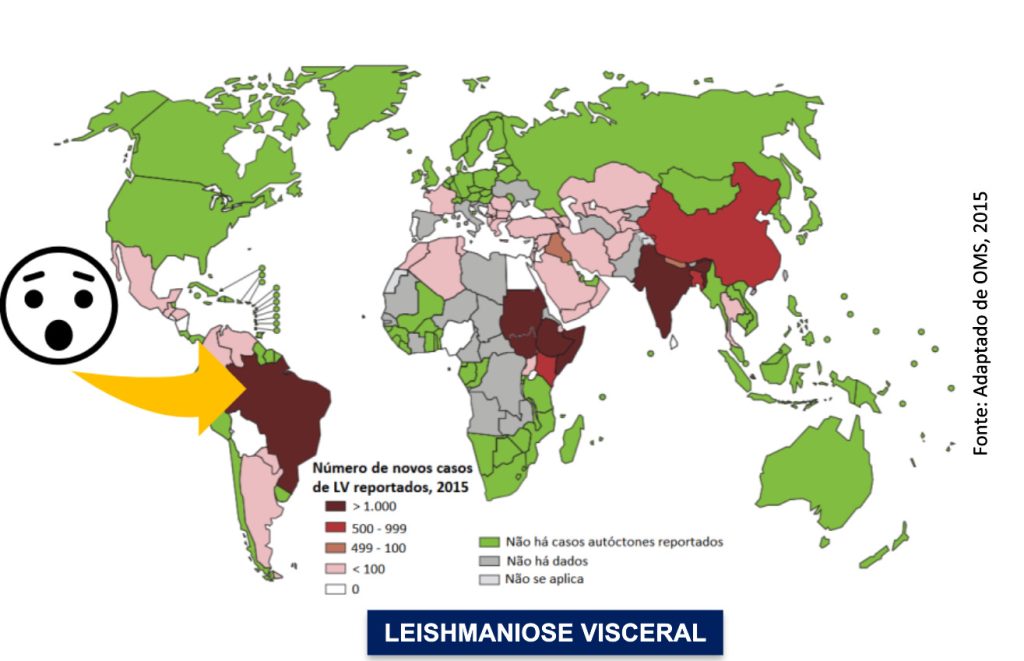
Os protozoários do gênero Leishmania são os agentes etiológicos da leishmaniose, um grupo de doenças que acomete mais de 12 milhões de pessoas. Cerca de 350 milhões de indivíduos em 88 países de todo o mundo estão localizados em área de risco de adquirir a doença e estima-se o aparecimento de 1,5 a 2 milhões de novos casos ao ano, muitos dos quais não são registrados (OMS, 2020).
SITUAÇÃO EPIDEMIOLÓGICA NO BRASIL E NO MUNDO
AGENTE ETIOLÓGICO – FORMAS EVOLUTIVAS
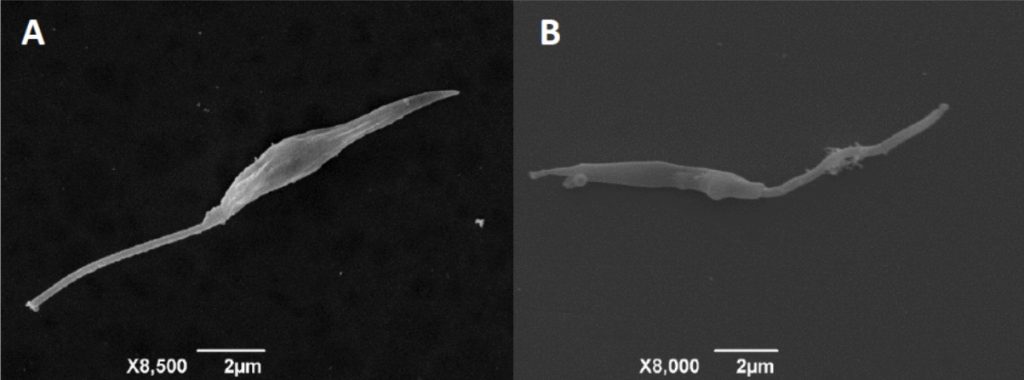
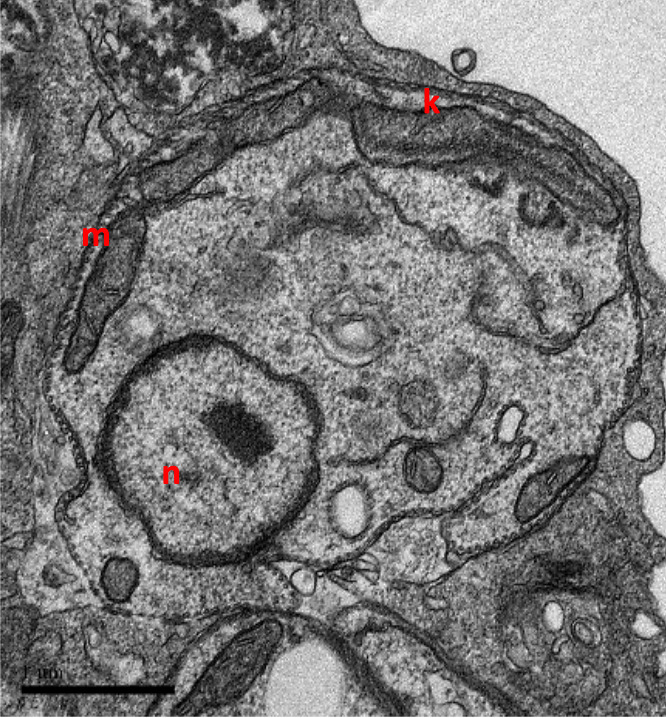
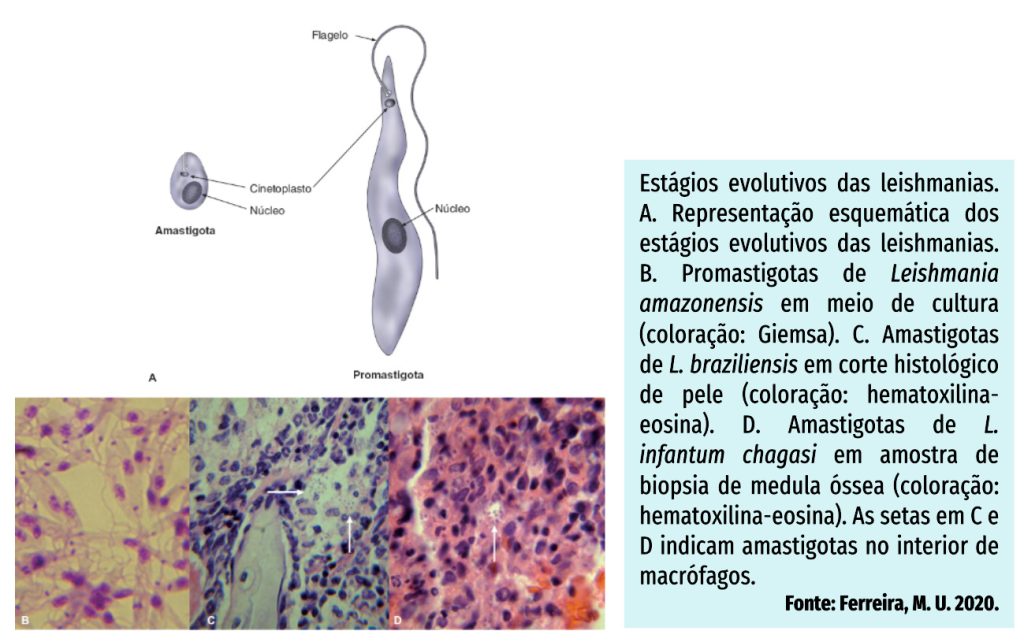
O gênero Leishmania compreende espécies de protozoários unicelulares, digenéticos (heteroxenos), pertencentes à ordem Kinetoplastida e à família Trypanosomatidae. Há aproximadamente 21 espécies de leishmania que são transmitidas por cerca de 30 espécies de insetos vetores. As principais espécies são: Leishmania donovani, L. infantum, L. major e L. tropica no Velho Mundo e L. mexicana, L. amazonensis, L. braziliensis e L. chagasi no Novo Mundo.
AGENTE ETIOLÓGICO – FORMAS EVOLUTIVAS

AGENTE ETIOLÓGICO – FORMAS EVOLUTIVAS
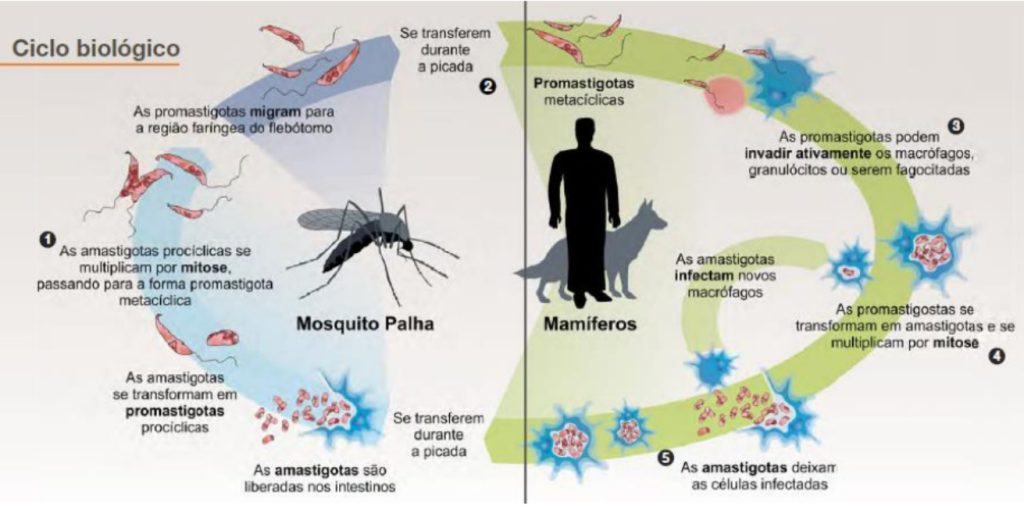
CICLO BIOLÓGICO
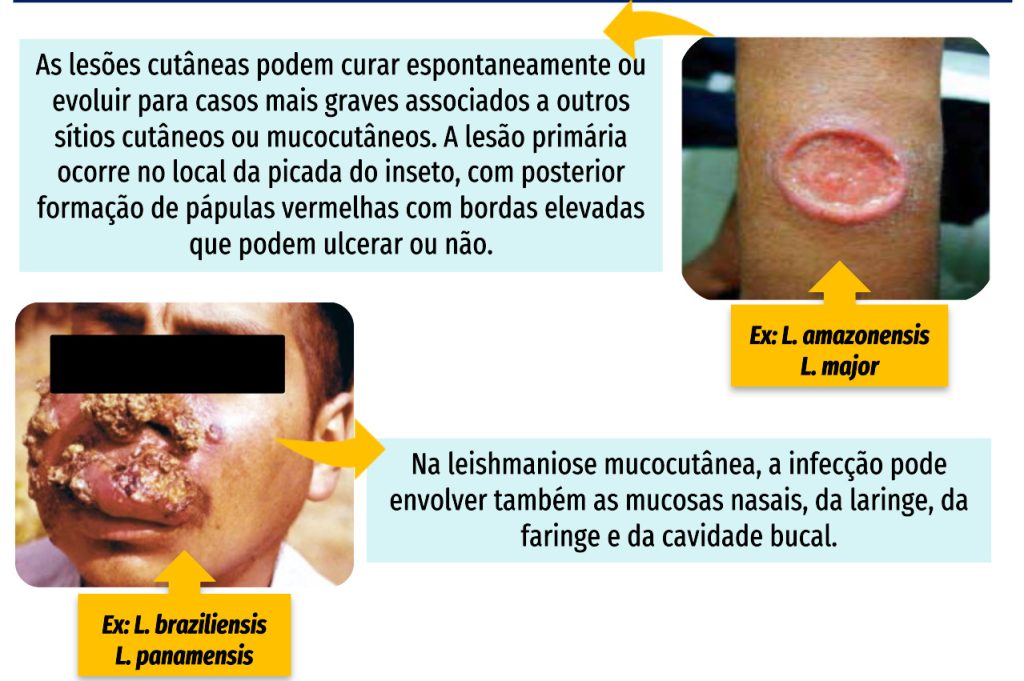
FORMAS CLÍNICAS – LEISHMANIOSE TEGUMENTAR
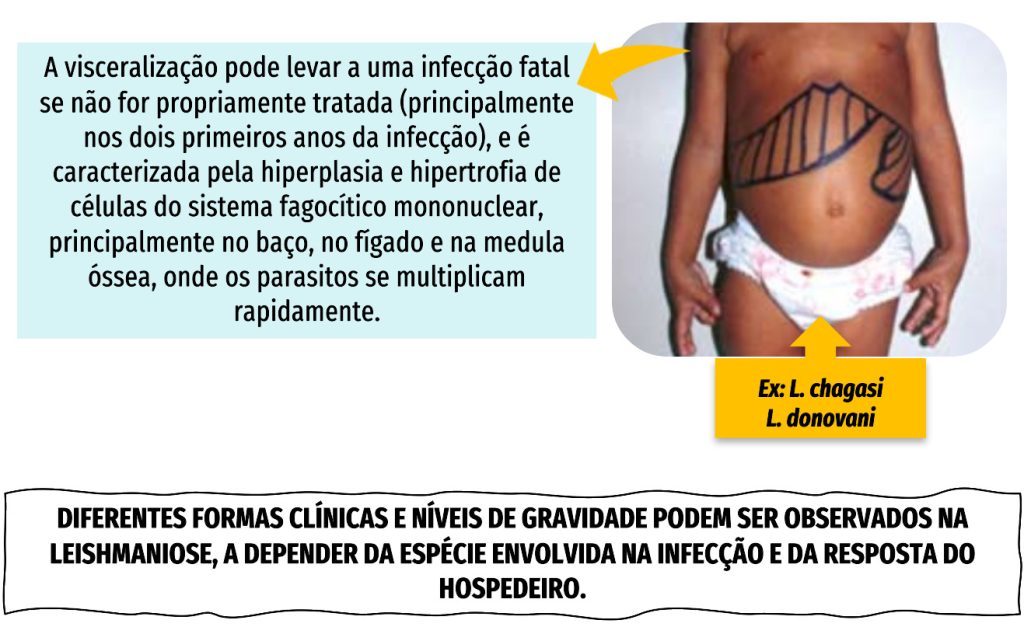
FORMAS CLÍNICAS – LEISHMANIOSE VISCERAL
IMUNOPATOLOGIA DAS LEISHMANIOSES
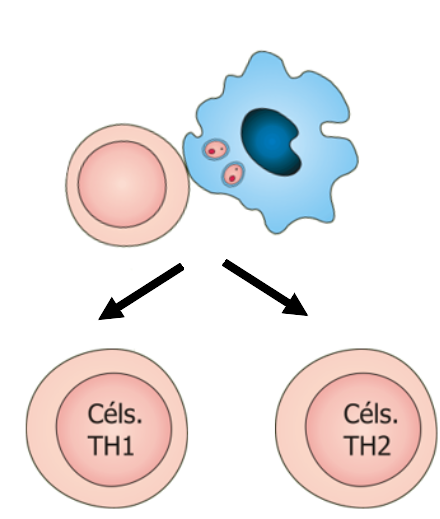
Na leishmaniose, promastigotas transmitidos pela picada de flebotomíneos são processados por células dendríticas e apresentados a células T virgens, que por sua vez produzem um padrão de citocinas resultando na formação de populações de células T diferenciadas e expandidas: células Th1, Th2 e T-reg. Quando as células Th1 são ativadas produzem interleucina-2 (IL-2), interferon-gama (IFN-γ) e fator de necrose tumoral (TNF-α). O IFN-γ é responsável por ativar macrófagos, que então combatem os protozoários. As células T-reg são então ativadas e modulam a resposta antimicrobiana contínua, limitando assim os danos ao hospedeiro. No entanto, quando a resposta Th2 predomina, a resposta Th1 é inibida e a infecção persiste com tendência a disseminação. Nas células do tipo Th2, diferenciadas na ausência de IL-12, secretam citocinas que impedem uma resposta efetiva contra patógenos intracelulares, entre elas a IL-4, IL-5, IL-13 e TGF-β.
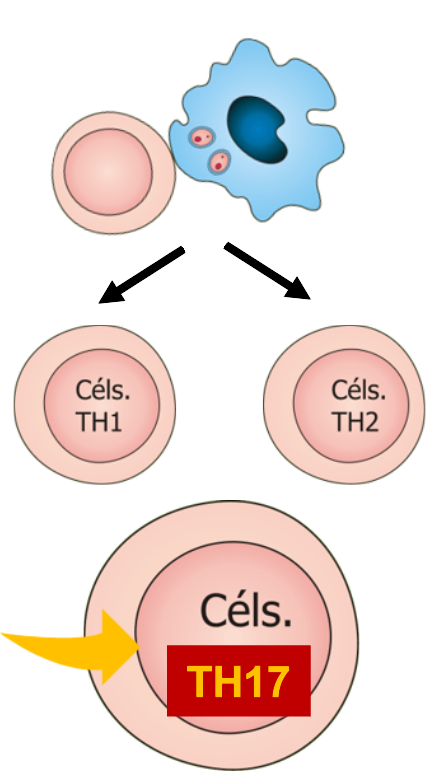
Além das subpopulações Th1, Th2 e Treg, as células Th17 vêm ganhando destaque na resposta contra a leishmania. O seu perfil ainda não é totalmente esclarecido. A IL-17 é produzida durante a fase ativa da leishmaniose tegumentar e está diretamente correlacionada à produção de TNF-α. Em compensação, níveis de IL-17 foram identificados em indivíduos infectados, mas que não desenvolveram a doença.
DIAGNÓSTICO
IMUNOLÓGICO OU INDIRETO
Mensuram a resposta do organismo diante de antígenos do parasito. Pode-se realizar ELISA, PCR e imunofluorescência indireta.

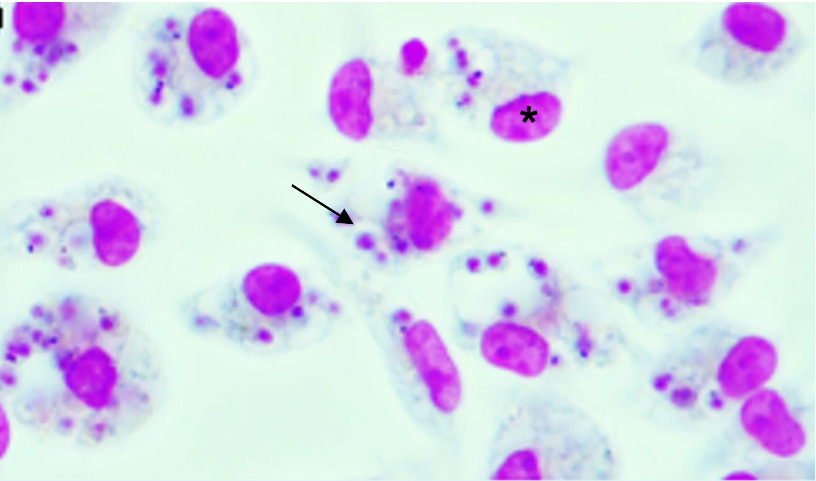
HISTOPATOLÓGICO
Na leishmaniose tegumentar, o material a ser examinado é obtido por biopsia, punção ou escarificação de lesões cutâneas ou mucosas. Na leishmaniose visceral, o material é obtido por aspiração da medula óssea ou, mais raramente, do fígado ou do baço.

PROFILAXIA
TRATAMENTO
ANTIMONIAIS PENTAVALENTES – GLUCANTIME E PENTOSTAM
O tratamento de primeira linha da leishmaniose consiste na utilização de antimoniais pentavalentes (Sb5+). A forma amastigota do parasito é sensível aos antimoniais, pois somente ela é capaz de realizar a redução química (da forma pentavalente para a forma trivalente) necessária para a ação do fármaco dentro do hospedeiro. Em casos de leishmaniose cutânea, a indicação é a utilização de 20 mg kg-1 durante 20 dias. Já em casos de leishmaniose visceral é recomendado o uso dessa mesma dose, entretanto, no período de 30 dias.
TRATAMENTO SUBSTITUTIVO
Em caso de falha terapêutica dos antimoniais pentavalentes, estas drogas podem ser substituídas pela anfotericina B (desoxicolato ou lipossomal), miltefosina, paromomicina e pentamidinas.
IMPORTANTE!!!
Ainda há muita dificuldade no tratamento da leishmaniose pela complexidade da doença, dadas as inúmeras combinações de diferentes síndromes, espécies e áreas geográficas de aquisição da doença, cada combinação diversificando na apresentação clínica e na história natural da doença. Além da complexidade da doença, deve-se avaliar a falta de quimioterápicos mais eficazes e com menor toxicidade do que os atualmente empregados.